Limit hidrokarbonlar: genel özellikleri, izomerliği, kimyasal özellikleri
Hidrokarbonlar en basit organik sınıftır.Maddeleri, sadece iki kimyasal element - karbon ve hidrojen atomlarına sahiptir. Çeşitli hidrokarbonların çoğu organik bileşik sınıfları kimyasal sentez yöntemleriyle elde edilir.
Hidrokarbonlar iki alt sınıfa ayrılmıştır -asiklik ve siklik. Asiklik hidrokarbonlar veya yağlı hidrokarbonlar veya alifatik hidrokarbonlar şunları içerir: doymuş hidrokarbonlar (alkanlar), doymamış (alkenler, alkinler, dienler), asiklik terpenler. Siklik hidrokarbonlar, sikloparafinler, arenler ve siklik terpenler grubuyla temsil edilir. Bazen terpenler biyoorganik kimya eğitimi amaçlarına yönlendirilir.
Limit hidrokarbonlar (alkanlar) - bileşiklerkarbon ve hidrojendir, karbon atomlarının birbirlerine basit bir bağ ile bağlanmasından sonra kalan tüm değerlerin hidrojen atomlarıyla doymuş olduğu moleküllerde. Tüm alkanlar, metan türevleri veya homologları olarak düşünülebilir. CH4 moleküler formülüne sahip olan metan, bir atom hidrojeni almaya çalışırsa, bir radikal CH3 oluşur. etan (C2H6) - dolayı, karbon gibi bir organik maddenin molekül içinde genellikle dört değerlikli olduğu gerçeğine iki Bu gibi radikallerin bağlantı homolog dizi ikinci bir temsilcisinin oluşmasına neden olurlar. propan - Hidrojen atomu, radikali, bir etil almak birinden etan, oluşturulduğu takdirde, üçüncü homolog bağlantı CH3 oluşturan sokulur, bundan sonra.
Propanın yapısal formülünü analiz etmek kolaydırmolekülünün iki tür karbon atomu (birincil ve ikincil) içerdiğini tespit etmek. Her birincil karbon atomu kendi değerlikli bir karbon atomuna, ikincil atom ise iki karbon atomlu iki değerlikle bağlanır. Hidrojen atomunu propanın birincil karbon atomundan alırsak, birincil propil oluşur, ikincil - ikincil propil. Birincil veya ikincil metil propil ilavesi, dördüncü homologun yapısal türlerinin oluşumuna yol açar. Düz zincirli bir karboksilik zincire sahip normal bütan ve dallı bir karbon zincirine sahip izobütan olmak üzere iki bileşik oluşturun.
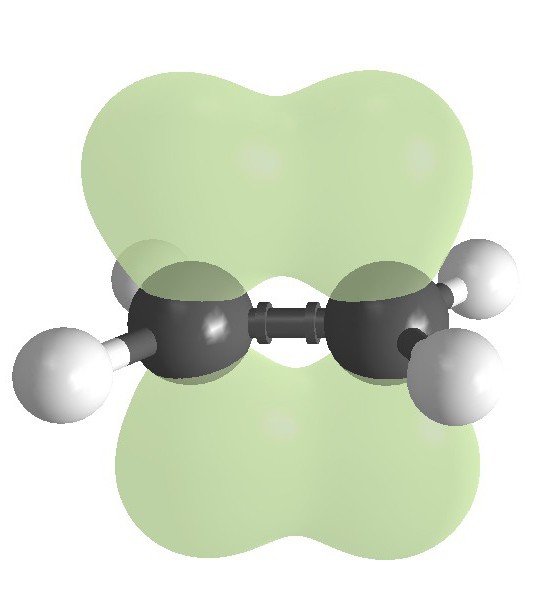
Limit hidrokarbonlar: yapı
Alkanların tipik bir temsilcisi metandır. Moleküler formül CH4. Alkane molekülleri bir sigma bağıyla karakterizedir. Metan molekülünde karbon atomu bir s ve üç p orbitaline bağlı olarak dört kovalent bağ oluşturur ve her bir hidrojen atomu s-orbitallerinden kaynaklanmaktadır.
Limit hidrokarbonlar: isimlendirme ve izomerlik
Yapısal homolog formüllerinin elde edilmesindeBir dizi metan, bütan C4H10 ile başlayarak, izomerizm fenomeniyle tanışırız. Örneğin, C4H10 moleküler formülü, C5H12 - üç olmak üzere iki ayrı bileşiğe karşılık gelir. Gelecekte izomer sayısı, alkan molekülündeki karbon atomlarının sayısındaki artışla birlikte artar. 9, S8N18 - - 18, C10H22 - 76 S12N26 - 355. ilk dört temsili alkanlar - beşinci on ikinci gaz - sıvı, altıncı yana - katı Örneğin, molekül formülü S6N14 beş yapısal formüller ve ayrı ayrı bileşikler, sırasıyla S7N16 karşılamak .
Doymuş hidrokarbonların kimyasal özellikleri
Tüm sınırlayıcı hidrokarbonlar inert maddelerdir. Bu, alkan moleküllerinde, karbon ve hidrojen atomlarının sigma bağları ile birbirine bağlandığı gerçeği ile açıklanır, bu nedenle bu bileşikler hidrojen atomlarını bağlayamaz. Alkanlar radikal halojenleme, nitrasyon ve bölünme reaksiyonlarına girer. Halojenerasyon sürecinde, halojen atomları alkan molekülündeki hidrojen atomlarının yerini kolaylıkla alır. Nitrürlendiğinde, nitro grubu tersiyer, ikincil ve birincil karbon atomlarında daha zor bir şekilde hidrojenin yerini alır.
Limit ve doymamış hidrokarbonlarçeşitli organik maddeler elde etmek için hammaddeler. Hidrojen atomlarını terminal hidrokarbonlardan ayırmak suretiyle, doymamış (alkenler, alkinler) elde etmek mümkündür.
</ p>